
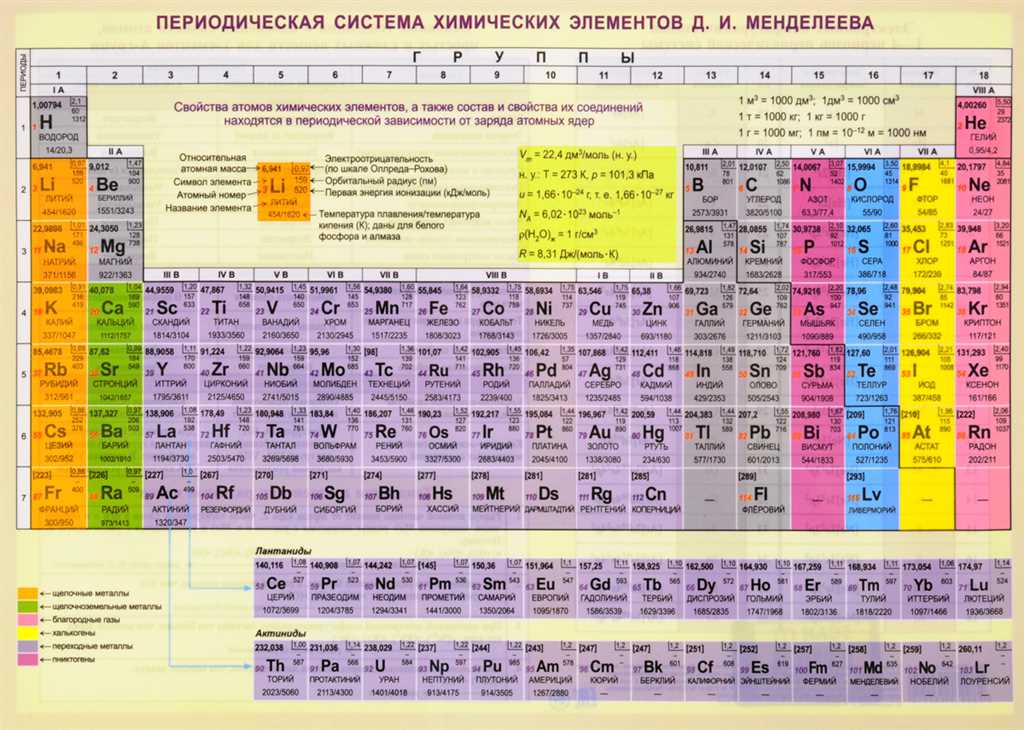
Периодическая система химических элементов – это систематическое представление всех известных химических элементов, упорядоченных по возрастанию атомного номера. Она является одной из важнейших информационных баз в химии и используется для классификации и организации знаний о различных элементах.
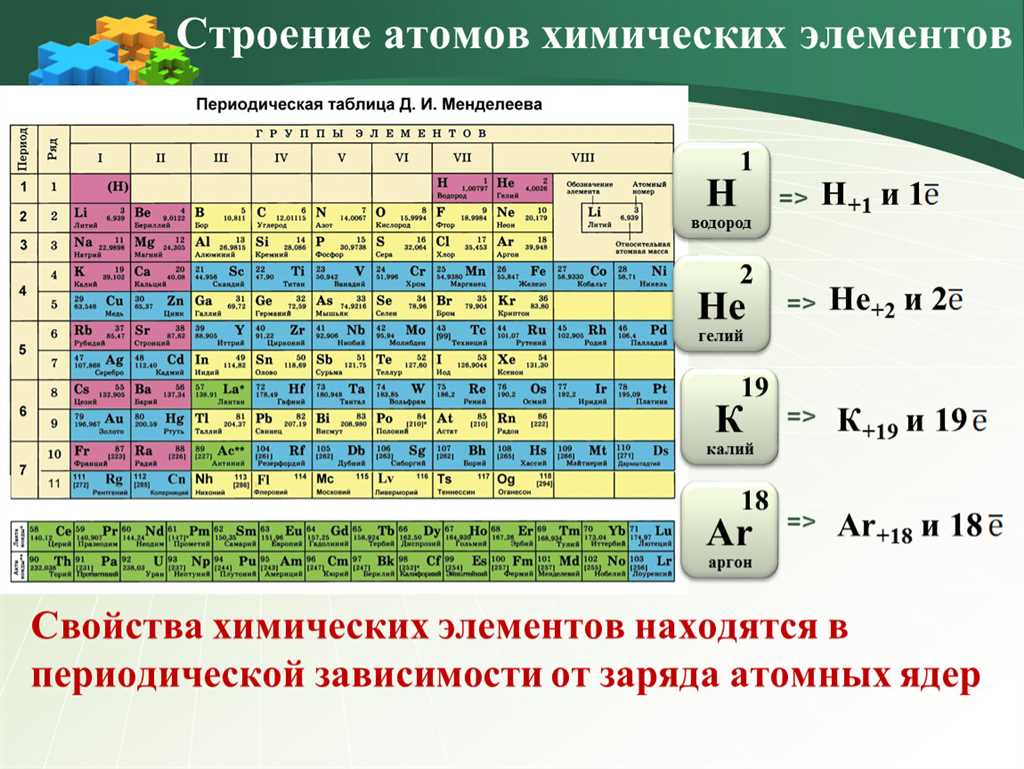
В таблице Менделеева находится 118 элементов. Они расположены в 7 горизонтальных рядах, называемых периодами, и 18 вертикальных столбцах, называемых группами. Каждый элемент обычно обозначается символом, состоящим из одной или двух букв латинского алфавита. Кроме того, у элементов есть атомный номер, который равен количеству протонов в атоме.
Некоторые элементы таблицы Менделеева уже были известны в древности, например, золото, серебро и олово. Однако, большинство элементов было открыто в XIX и XX веках. Распределение элементов в таблице Менделеева основано на их свойствах, атомных и массовых числах.
История создания таблицы Менделеева
Периодическая система химических элементов, также известная как таблица Менделеева, является основой современной химии. Она представляет собой организацию и классификацию всех известных химических элементов в упорядоченную таблицу.
История создания таблицы Менделеева началась в XIX веке. В течение долгого времени химики пытались систематизировать все элементы и установить связи между ними. Но только в 1869 году русский химик Дмитрий Иванович Менделеев разработал первую полную и удобную для использования таблицу Менделеева.
Менделеев основывал свою таблицу на классификации химических элементов по их атомным свойствам, с учетом их атомных масс. Каждый элемент был расположен в таблице в порядке возрастания атомной массы.
Таблица Менделеева была представлена в виде сетки, где горизонтальные строки представляли периоды, а вертикальные столбцы – группы элементов. Периоды отражали энергетические уровни электронов в атоме, а группы группировали элементы схожих свойств.
Одной из ключевых особенностей таблицы Менделеева стало то, что некоторые элементы были пропущены, но Менделеев оставил для них пустые места. Используя свои знания о химических свойствах и трендах, он предсказал существование еще неизвестных на тот момент элементов и даже предложил для них имена.
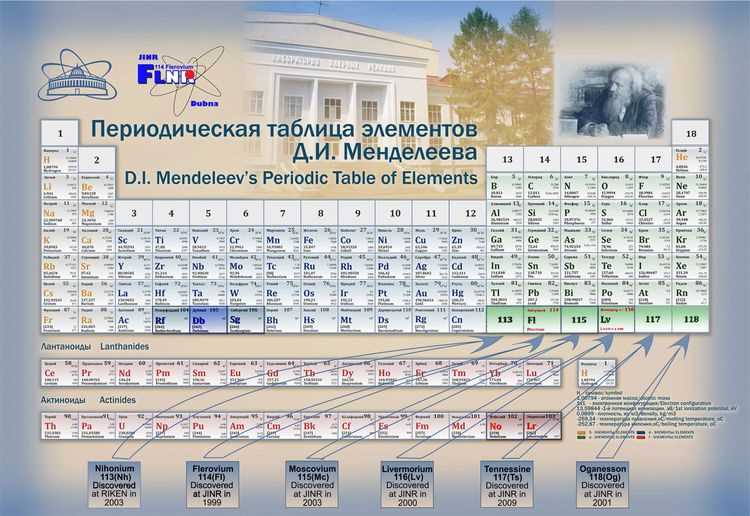
С течением времени, с развитием науки и открытием новых элементов, таблица Менделеева постепенно дорабатывалась и обновлялась. Сегодня она содержит 118 элементов, расположенных по семи периодам и 18 группам.
Таблица Менделеева является важной основой для понимания и изучения химических элементов и их свойств. Она помогает химикам классифицировать элементы, определять их свойства и прогнозировать их взаимодействия.
Периодическая система химических элементов
Периодическая система химических элементов является удобной системой классификации химических элементов, разработанной Дмитрием Ивановичем Менделеевым в 1869 году. Она основана на упорядочении элементов по возрастанию их атомных номеров и организации их в таблицу, которая позволяет наглядно отображать их свойства и закономерности.
В периодической системе химические элементы расположены в 7 горизонтальных рядах, называемых периодами. Первый период состоит из двух элементов — водорода и гелия, второй период содержит восемь элементов, третий период — 8 элементов, и так далее. На самом деле, на данный момент периодическая система содержит 7 периодов, однако существуют исследования и предположения о возможности расширения периодической системы.
В периодической системе элементы также расположены вертикально в 18 группах, которые определяют сходство их химических свойств. Каждая группа имеет свой номер и обозначение, например, первая группа — группа щелочных металлов, вторая группа — группа щелочноземельных металлов, третья группа — группа бора и так далее.
Периодическая система также включает в себя блоки элементов — s-блок, p-блок, d-блок и f-блок. Благодаря периодической системе мы можем легко определить химические свойства элементов, их относительную атомную массу, электронную конфигурацию и другие важные характеристики.
| Период | Группа | Символ | Название |
|---|---|---|---|
| 1 | 1 | H | Водород |
| 1 | 2 | He | Гелий |
| 2 | 1 | Li | Литий |
| 2 | 2 | Be | Бериллий |
Таким образом, периодическая система химических элементов является неотъемлемой частью изучения химии и является основой для понимания и классификации различных элементов и их свойств.
Поиск закономерностей
Систематика элементов в таблице Менделеева позволяет нам обнаружить ряд закономерностей и трендов в их свойствах и химическом поведении. Эти закономерности помогают установить связи между элементами и предсказать их химические свойства на основе их расположения в таблице.
Одним из основных закономерностей, которую мы можем наблюдать в таблице Менделеева, является периодическая система элементов. Все элементы расположены в порядке возрастания их атомных номеров и разделены на периоды и группы. Каждый период представляет собой горизонтальную строку элементов, а каждая группа — вертикальный столбец элементов.
Свойства элементов, такие как радиус атома, электроотрицательность и валентность, меняются систематически от одной группы к другой и от одного периода к другому. Например, в верхней левой части таблицы находятся металлы щелочных металлов (группа 1), которые обладают низкой электроотрицательностью и способностью образовывать ион с положительным зарядом. В нижней правой части таблицы находятся неметаллы галогены (группа 17), которые обладают высокой электроотрицательностью и способностью образовывать ион с отрицательным зарядом.
Еще одной важной закономерностью, которую можно наблюдать в таблице Менделеева, является закон периодичности химических свойств элементов. Этот закон утверждает, что химические свойства элементов повторяются с определенной периодичностью. Например, элементы одной и той же группы имеют схожие химические свойства и образуют аналогичные соединения.
Кроме того, в таблице Менделеева можно обнаружить другие закономерности, такие как закон сохранения массы и закон сохранения заряда, которые связаны с реакционными свойствами элементов и их способностью образовывать соединения с определенными пропорциями.
Таким образом, таблица Менделеева является мощным инструментом для изучения химических закономерностей и связей между элементами. Она позволяет нам лучше понять строение и свойства вещества и использовать эти знания для развития новых материалов и технологий.
Открытие новых элементов
Таблица Менделеева является основой химической науки и включает все известные элементы. Однако, с течением времени некоторые элементы были открыты и добавлены в таблицу. Ниже представлены некоторые примеры открытия новых элементов.
-
Германий (Ge) — был открыт в 1886 году немецким химиком Клеменсом Винклером. Он обнаружил этот элемент при исследовании руды, содержащей свинец, и назвал его в честь своей родины — Германии.
-
Радий (Ra) — был открыт в 1898 году Марией и Пьером Кюри. Они изолировали его из образцов урана и назвали его в честь латинского слова «radius», что означает «луч».
-
Плутоний (Pu) — был открыт в 1940 году американскими учеными Гленом Сиборгом и Эдвином Макмилланом. Они синтезировали этот элемент в лаборатории и назвали его в честь планеты Плутон.
Это только некоторые примеры открытия новых элементов. С течением времени и с развитием научных методов мы можем ожидать открытия еще большего количества элементов и расширения таблицы Менделеева.
Состав и структура таблицы Менделеева
Таблица Менделеева – это систематическое представление химических элементов, которое образует основу для организации и классификации элементов. Она была создана русским химиком Дмитрием Ивановичем Менделеевым в 1869 году.
Таблица Менделеева представляет собой четко структурированную таблицу, в которой элементы расположены в порядке возрастания их атомных номеров. Каждый химический элемент представлен квадратным блоком, называемым ячейкой, в которой указываются его символ, атомный номер и атомная масса.
Ячейки таблицы Менделеева группируются в ряды, столбцы и блоки в соответствии с химическими свойствами элементов. Горизонтальные ряды называются периодами, а вертикальные столбцы – группами. Группы обычно обозначаются цифрами или буквами. В таблице Менделеева также выделяются блоки s, p, d и f, которые указывают на тип орбиталей, на которых располагаются электроны последних заполненных энергетических уровней.
Таблица Менделеева имеет несколько расширенных форматов, включающих дополнительные данные о химических свойствах элементов, такие как электроотрицательность, радиус атома и т.д. Однако базовая структура и порядок элементов остаются неизменными во всех версиях таблицы.
Таблица Менделеева является одним из важнейших инструментов химии, позволяющим ученым организовать и систематизировать знания о химических элементах. Она позволяет с легкостью определить различные химические свойства элементов и предсказать их взаимодействия и реакции.
Использование таблицы Менделеева в изучении химии существенно упрощает процесс обучения, помогает учащимся лучше понять и запомнить множество фактов о различных элементах и применять полученные знания в практических задачах.
Семейства и периоды
Таблица Менделеева представляет собой организацию химических элементов в виде таблицы, в которой элементы расположены по порядку их атомных номеров. В таблице Менделеева каждый элемент имеет свое место в определенном ряду (периоде) и на определенной вертикальной линии (группе).
Периоды — это строки таблицы Менделеева. Всего в таблице Менделеева существует 7 периодов. Каждый период начинается с элемента, который имеет наибольший атомный номер в данном периоде. Каждый следующий элемент в периоде имеет атомный номер на единицу больше, чем у предыдущего элемента в периоде.
Семейства — это столбцы таблицы Менделеева. Всего в таблице Менделеева существует 18 семейств. Семейства часто называют группами. Элементы в каждом семействе имеют сходные свойства и химические реакции.
Семейства делятся на две основные группы: s-семейства и p-семейства. S-семейства находятся слева в таблице Менделеева, а p-семейства находятся справа от s-семейств. Семейства с номерами от 1 до 2 и 13 до 18 являются p-семействами, а семейства с номерами от 3 до 12 являются s-семействами.
Каждое семейство имеет свой номер. У семейства также есть свое название. Некоторые семейства называются по названию элемента, находящегося в первой вертикальной линии (группе) данного семейства. Например, первое семейство называется семейством лития, так как первый элемент в этом семействе — литий (Li).
Ниже приведена таблица с семействами и периодами.
| Период | 1 семейство | 2 семейство | 3 семейство | 4 семейство | 5 семейство | 6 семейство | 7 семейство | 8 семейство | 9 семейство | 10 семейство | 11 семейство | 12 семейство | 13 семейство | 14 семейство | 15 семейство | 16 семейство | 17 семейство | 18 семейство |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Гидроген (H) | Щелочноземельные металлы | Переходные металлы | p-семейства | Переходные металлы | Щелочные металлы | Главная подгруппа | Титан (Ti) | Ванадий (V) | Хром (Cr) | Марганец (Mn) | Железо (Fe) | Кобальт (Co) | Никель (Ni) | Медь (Cu) | Цинк (Zn) | Бор (B) | |
| 2 | Гелий (He) | Главная подгруппа | ||||||||||||||||
| 3 | Литий (Li) | Берилий (Be) | Главная подгруппа | Главная подгруппа | ||||||||||||||
| 4 | p-семейства | Бор (B) | Углерод (C) | Азот (N) | Кислород (O) | Фтор (F) | Неон (Ne) | Галогены | Гелий (He) | |||||||||
| 5 | ||||||||||||||||||
| 6 | Главная подгруппа | Бор (B) | Аллюминий (Al) | Германий (Ge) | Мышьяк (As) | Селен (Se) | Бром (Br) | Криптон (Kr) | Гелий (He) | |||||||||
| 7 | Главная подгруппа | Бор (B) | Аллюминий (Al) | Германий (Ge) | Мышьяк (As) | Селен (Se) | Бром (Br) | Криптон (Kr) | Гелий (He) | |||||||||
| 8 | Главная подгруппа | Гелий (He) | ||||||||||||||||
| 9 | ||||||||||||||||||
| 10 | Главная подгруппа | |||||||||||||||||
| 11 | Главная подгруппа | Гелий (He) | Лантан (La) | Серия лантаноидов | Актиний (Ac) | Серия актиноидов | Гелий (He) | |||||||||||
| 12 | Главная подгруппа | Гелий (He) | ||||||||||||||||
| 13 | Бор (B) | p-семейства | Главная подгруппа | Серия алюминиевых металлов | p-семейства | Главная подгруппа | Главная подгруппа | |||||||||||
| 14 | Главная подгруппа | Силиций (Si) | Легкий металл | Фосфор (P) | Сера (S) | Хлор (Cl) | Аргон (Ar) | Гелий (He) | Тяжелый металл | |||||||||
| 15 | Главная подгруппа | Гелий (He) | Гелий (He) | Главная подгруппа | ||||||||||||||
| 16 | Главная подгруппа | Кислород (O) | Сера (S) | Главная подгруппа | ||||||||||||||
| 17 | Главная подгруппа | Хлор (Cl) | Главная подгруппа | |||||||||||||||
| 18 | Главная подгруппа | Гелий (He) |
Главные группы и подгруппы элементов
Таблица Менделеева — это систематическая таблица, в которой элементы разделены на главные группы и подгруппы в зависимости от своих свойств и химической активности.
Главные группы элементов располагаются вертикально в таблице и имеют общую химическую конфигурацию электронов на своих внешних оболочках. В таблице Менделеева всего 8 главных групп элементов.
Вот список главных групп элементов:
- 1 группа — щелочные металлы (Li, Na, K, Rb, Cs, Fr)
- 2 группа — щелочноземельные металлы (Be, Mg, Ca, Sr, Ba, Ra)
- 3 группа — бор (B), алюминий (Al), галлий (Ga), индий (In), таллий (Tl)
- 4 группа — углерод (C), кремний (Si), германий (Ge), олово (Sn), свинец (Pb)
- 5 группа — азот (N), фосфор (P), арсен (As), антимон (Sb), бисмут (Bi)
- 6 группа — кислород (O), сера (S), селен (Se), теллур (Te), полоний (Po)
- 7 группа — фтор (F), хлор (Cl), бром (Br), йод (I), астат (At)
- 8 группа — гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe), радон (Rn)
Каждая группа характеризуется общими свойствами и химической активностью. Например, щелочные металлы первой группы очень реактивные и образуют ион положительного заряда, а галогены седьмой группы образуют ионы отрицательного заряда. Главные группы элементов являются основой для классификации и изучения химических свойств элементов.
Внутри каждой главной группы элементы также разделены на подгруппы в зависимости от их электронной конфигурации и химических свойств. Например, щелочные металлы второй подгруппы (Mg, Ca, Sr, Ba, Ra) обладают похожими свойствами и более высокой активностью по сравнению с элементами первой подгруппы (Be).
| Группа | Подгруппа | Элементы |
|---|---|---|
| 1 | А | Li, Na, K, Rb, Cs, Fr |
| Б | H | |
| 2 | А | Be, Mg, Ca, Sr, Ba, Ra |
| Б | Hg | |
| 3 | — | B, Al, Ga, In, Tl |
| 4 | — | C, Si, Ge, Sn, Pb |
| 5 | — | N, P, As, Sb, Bi |
| 6 | — | O, S, Se, Te, Po |
| 7 | — | F, Cl, Br, I, At |
| 8 | А | He, Ne, Ar, Kr, Xe, Rn |
| Б | Og |
Элементы в таблице Менделеева упорядочены таким образом, что подобные элементы располагаются рядом друг с другом. Это облегчает исследование и понимание химических закономерностей и регулярностей в свойствах элементов.













