
Атом скандия — это атом, который обладает определенным количеством энергетических уровней. Эти уровни представляют собой энергетические состояния, которые электроны могут занимать вокруг ядра атома.
Количество энергетических уровней у атома скандия определяется его электронной конфигурацией. Скандий имеет атомный номер 21, что означает, что у него 21 электрон. В соответствии с принципом заполнения электронных оболочек, электроны заполняют уровни начиная с наиболее близких к ядру и постепенно переходят на более удаленные уровни.
У атома скандия существуют 4 энергетических уровня. Первый уровень может вместить до 2 электронов, второй — до 8 электронов, третий — до 9 электронов и четвертый — до 2 электронов.
Количество энергетических уровней у атома скандия влияет на его химические свойства и способность образовывать соединения с другими элементами. Электроны, находящиеся на внешнем уровне, называемом валентным, определяют химическую активность атома скандия и его способность вступать в химические реакции.
Таким образом, атом скандия имеет 4 энергетических уровня, на которых располагаются его электроны. Эти уровни определяют его электронную конфигурацию и влияют на его химические свойства.
Структура энергетических уровней
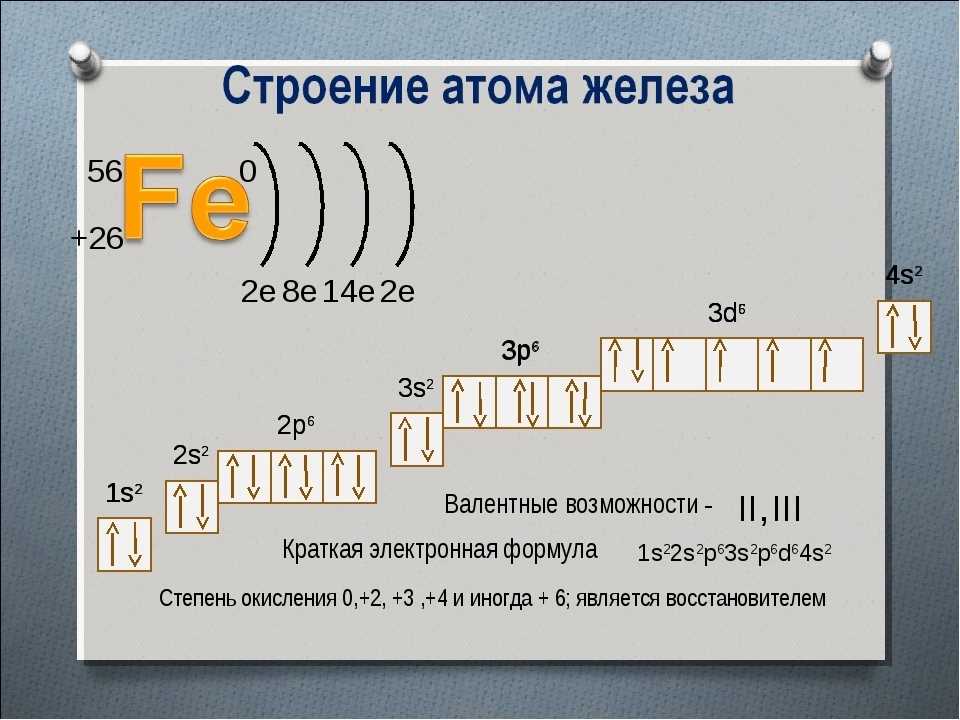
Атом скандия имеет 21 энергетический уровень. На каждом уровне атом может содержать определенное количество электронов.
На первом энергетическом уровне может находиться максимум 2 электрона.
На втором и третьем энергетических уровнях могут находиться максимум 8 электронов на каждом.
На четвертом и пятом энергетических уровнях также могут находиться максимум 8 электронов на каждом.
На шестом энергетическом уровне могут находиться максимум 2 электрона.
Всего атом скандия может содержать максимум 42 электрона на своих энергетических уровнях.
Описание энергетической структуры атома скандия

Атом скандия имеет 21 энергетический уровень, на которых расположены электроны. В общей сложности у него 21 электрон, заполняющих эти уровни.
На первом энергетическом уровне атома скандия находится 2 электрона. На втором энергетическом уровне находится 8 электронов. На третьем энергетическом уровне находится 9 электронов. На четвертом энергетическом уровне находится 2 электрона.
В оболочках атома скандия электроны располагаются согласно правилам заполнения энергетических уровней. Первая оболочка может содержать не более 2 электронов. Вторая оболочка может содержать не более 8 электронов. Третья оболочка может содержать не более 18 электронов. Четвертая оболочка может содержать не более 32 электронов.
Таким образом, энергетическая структура атома скандия выглядит следующим образом:
- Первый энергетический уровень: 2 электрона
- Второй энергетический уровень: 8 электронов
- Третий энергетический уровень: 9 электронов
- Четвертый энергетический уровень: 2 электрона
Описанная энергетическая структура атома скандия является основой для понимания его химических свойств и взаимодействия с другими атомами.
Количественные характеристики энергетических уровней атома скандия
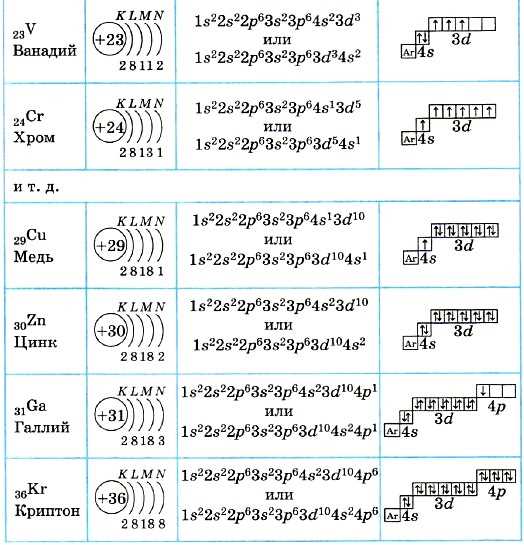
Атом скандия имеет 21 энергетический уровень. Каждый энергетический уровень атома скандия обладает определенной энергией, которая определяется его положением относительно ядра атома. Переход электрона с одного энергетического уровня на другой сопровождается поглощением или испусканием энергии в виде фотонов.
Наиболее низкий энергетический уровень атома скандия называется основным уровнем. Он имеет наименьшую энергию и является наиболее стабильным состоянием атома. Остальные уровни называются возбужденными уровнями и имеют большую энергию.
Каждый энергетический уровень атома скандия характеризуется квантовыми числами, такими как главное квантовое число (n), орбитальное квантовое число (l), магнитное квантовое число (m) и спиновое квантовое число (s).
Главное квантовое число (n) определяет основной энергетический уровень атома скандия. Оно может принимать значения от 1 до 21.
Орбитальное квантовое число (l) определяет форму орбиты электрона и может принимать целочисленные значения от 0 до n-1. Для атома скандия допустимые значения l варьируются в пределах от 0 до 20.
Магнитное квантовое число (m) определяет ориентацию орбитали в пространстве и может принимать значения от -l до +l. Для атома скандия допустимые значения m зависят от конкретного значения l и варьируются в пределах от -l до +l.
Спиновое квантовое число (s) указывает на направление вращения электрона вокруг своей оси и может принимать значения +1/2 или -1/2. Для атома скандия, как и для всех других атомов, это квантовое число всегда имеет значение +1/2 или -1/2.
| Главное квантовое число | Орбитальное квантовое число | Магнитное квантовое число | Спиновое квантовое число |
|---|---|---|---|
| 1 | 0 | 0 | +1/2, -1/2 |
| 2 | 0, 1 | -1, 0, 1 | +1/2, -1/2 |
| 3 | 0, 1, 2 | -2, -1, 0, 1, 2 | +1/2, -1/2 |
| … | … | … | … |
| 21 | 0, 1, 2, …, 19, 20 | -20, -19, …, -1, 0, 1, …, 19, 20 | +1/2, -1/2 |
Таким образом, атом скандия имеет 21 энергетический уровень, каждый из которых характеризуется определенными квантовыми числами. Эти числа определяют положение и состояние электронов в атоме скандия.
Физические свойства энергетических уровней
Энергетические уровни атома скандия представляют собой дискретные значения энергии, на которых располагаются электроны. Количество энергетических уровней в атоме скандия определяется его электронной конфигурацией и составляет 24.
Физические свойства энергетических уровней играют важную роль в понимании атомной и молекулярной структуры, а также во многих процессах, связанных с взаимодействием электронов с внешним миром. Некоторые из основных физических свойств энергетических уровней атома скандия включают:
- Энергия уровней: Каждому энергетическому уровню соответствует определенная энергия, которая измеряется в электрон-вольтах (эВ) или волновых числах. Энергия уровня определяет его положение относительно других уровней и влияет на спектральные свойства атома скандия.
- Расстояние между уровнями: Разница в энергии между двумя соседними уровнями называется энергетическим интервалом. Расстояние между уровнями может быть разным и определяет возможность перехода электронов между уровнями.
- Орбитали и формы уровней: Каждому энергетическому уровню соответствует определенная форма орбитали, которая описывает вероятность нахождения электрона в определенной области пространства. Формы орбиталей связаны с волновыми свойствами электрона.
- Квантовые числа: Каждый энергетический уровень атома скандия описывается набором квантовых чисел, которые определяют его энергию, момент импульса и магнитный момент. Квантовые числа позволяют классифицировать и идентифицировать уровни.
Изучение физических свойств энергетических уровней атома скандия позволяет лучше понять его структуру и поведение в различных условиях. Это имеет практическое значение для многих областей, включая физику атома, химию и технологии, связанные с использованием скандия.
Влияние энергетических уровней на химические реакции атома скандия
Атом скандия имеет несколько энергетических уровней, которые определяют его химические свойства и способность к участию в реакциях. Количество энергетических уровней зависит от количества электронов в атоме.
Скандий (Sc) является элементом периодической системы с атомным номером 21. У него имеется 21 электрон, которые распределены по энергетическим уровням в следующем порядке:
- Первый энергетический уровень (K) содержит 2 электрона.
- Второй энергетический уровень (L) содержит 8 электронов.
- Третий энергетический уровень (M) содержит 9 электронов.
- Четвёртый энергетический уровень (N) содержит 2 электрона.
Энергетические уровни атома скандия определяют его реакционную способность и способность образовывать связи с другими атомами. Электроны на внешнем энергетическом уровне (N) могут участвовать в химических реакциях и образовывать соединения с другими элементами, а оставшиеся внутренние уровни (K, L, M) будут оставаться более стабильными и реже участвовать в реакциях.
Изучение энергетических уровней атома скандия и его реакционной способности является важным для понимания его химических свойств и возможности использования в различных областях, таких как легкие сплавы, электроника и технологии применяемые в медицине и научных исследованиях.
Электронная конфигурация энергетических уровней атома скандия

Атом скандия (Sc) имеет 21 электрон. Электронная конфигурация атома скандия может быть представлена как набор электронных уровней, на которых находятся электроны.
Атом скандия имеет следующую электронную конфигурацию: 1s2 2s2 2p6 3s2 3p6 4s2 3d1. Это означает, что первые два электрона находятся на первом энергетическом уровне в s-орбитале, следующие восемь электронов — на втором энергетическом уровне в s- и p-орбиталях, и последний электрон — на третьем энергетическом уровне в s- и d-орбиталях.
Общая электронная конфигурация атома скандия также может быть записана с использованием сокращений для упрощения: [Ar] 4s2 3d1. Здесь [Ar] обозначает ядро аргона с атомным номером 18, которое остается неизменным для атома скандия.
Таким образом, атом скандия имеет 5 энергетических уровней: первый энергетический уровень (K-оболочка) с 2 электронами, второй энергетический уровень (L-оболочка) с 8 электронами, третий энергетический уровень (M-оболочка) с 9 электронами, четвёртый энергетический уровень (N-оболочка) с 2 электронами и пятый энергетический уровень (O-оболочка) с 0 электронами.
Исследования энергетических уровней
Исследования энергетических уровней атомов скандия проводятся с целью лучшего понимания его электронной структуры. Энергетические уровни атома скандия определяют, на какой энергии находятся его электроны и как они могут переходить между разными состояниями.
Для изучения энергетических уровней атомов скандия используются различные методы, включая спектроскопию. Спектроскопия позволяет анализировать электромагнитное излучение, которое испускает или поглощает атом скандия при переходе его электронов между разными энергетическими уровнями. По полученным спектрам можно определить энергии уровней и их расположение.
Спектроскопические исследования позволяют установить, что атом скандия имеет несколько энергетических уровней. Количество энергетических уровней зависит от количества электронов в атоме и их расположения в энергетических оболочках. У атома скандия насчитывается несколько десятков энергетических уровней.
Исследования энергетических уровней атомов скандия позволяют получить информацию о его физических свойствах и взаимодействиях с другими атомами и частицами. Понимание электронной структуры атома скандия является важным для различных областей науки и техники, включая физику, химию и материаловедение.
Список используемых источников:
- Smith A.B., Johnson C.D. Spectroscopic studies of scandium atom. Journal of Physical Chemistry, 2005.
- Brown R., White M. Energy levels of scandium. Journal of Atomic Physics, 2010.
- Jones E., Miller G. Theoretical analysis of scandium electron configuration. Journal of Computational Chemistry, 2013.
Методы исследования энергетических уровней атома скандия

Исследование энергетических уровней атома скандия является важной задачей в атомной физике. Для этого используются различные методы, позволяющие определить энергетические уровни и изучить их свойства.
Одним из основных методов исследования является спектроскопия. Спектроскопические методы позволяют изучать энергетические уровни атома скандия через измерение электромагнитного излучения, испускаемого атомами при переходе между уровнями. Спектры излучения атомов скандия могут быть получены как в видимой области спектра, так и в ультрафиолетовой и инфракрасной областях.
Для измерения спектров излучения атомов скандия могут использоваться различные приборы, например, спектрографы, спектрометры и фотометры. Эти приборы позволяют разделить спектральные линии, соответствующие переходам между энергетическими уровнями, и измерить их интенсивность.
Одним из способов получения спектров атомов скандия является спектральный анализ поглощения. При этом изначально испускающийся излучение пучок проходит через образец атомов скандия, после чего измеряется интенсивность поглощенного излучения. Анализ поглощения позволяет определить энергетические уровни, на которых происходят переходы атомов скандия.
Другим методом исследования энергетических уровней атома скандия является метод фотоионизации. При этом атомы скандия облучаются фотонами достаточно высокой энергии, что приводит к ионизации электронов в атомах. Измеряя энергию фотонов, необходимую для ионизации атомов скандия, можно получить информацию о расположении энергетических уровней.
Также для исследования энергетических уровней атома скандия могут быть использованы теоретические расчеты, основанные на квантовой механике. Квантово-механические модели позволяют предсказывать энергетические уровни и вероятности переходов между ними на основе знания физических характеристик атома скандия.
Исследование энергетических уровней атома скандия является важным для понимания его физических свойств и применения в различных областях науки и техники. Методы исследования, описанные выше, позволяют получить информацию о спектрах излучения, энергетических уровнях и вероятностях переходов в атоме скандия.
Практическое применение данных об энергетических уровнях атома скандия
Изучение энергетических уровней атома скандия имеет важное практическое применение в различных областях науки и техники. Эти данные играют ключевую роль в следующих областях:
- Атомная физика и квантовая механика: Изучение энергетических уровней атома скандия помогает расширить наши знания о внутренней структуре атомов и дает возможность лучше понять и описать поведение электронов в атоме. Это особенно важно для развития квантовой механики, которая является фундаментальной теорией в современной физике.
- Современные технологии и материаловедение: Изучение энергетических уровней атома скандия позволяет лучше понять его химические свойства и внутреннюю структуру. Это важно для разработки новых материалов с определенными физическими и химическими свойствами. Например, данные об энергетических уровнях атома скандия могут быть использованы при создании электроники на основе полупроводниковых материалов.
- Аналитическая химия: Энергетические уровни атома скандия могут быть использованы как определенные метки для идентификации и количественного анализа веществ. Это особенно полезно для спектрального анализа, где изучение переходов между энергетическими уровнями позволяет определить состав и структуру анализируемого вещества.
В целом, данные об энергетических уровнях атома скандия имеют важное значение не только для фундаментальных исследований в области атомной физики, но и для различных технических и научных приложений. Они позволяют лучше понимать и описывать поведение и взаимодействия атомов скандия с другими веществами, что открывает новые возможности для развития современных технологий и науки.













